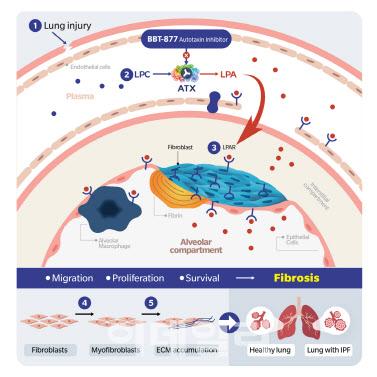
 |
BBT-877의 기전. (사진=브릿지바이오테라퓨틱스) |
브릿지바이오테라퓨틱스, 4차 IDMC BBT-877 임상 지속 권고
브릿지바이오테라퓨틱스는 지난 8일(미국 시간) 개최된 제4차 독립적 자료 모니터링 위원회(IDMC)로부터 특발성 폐섬유증(IPF) 치료제 후보물질 BBT-877의 제2상 임상시험을 지속하도록 권고 받았다고 밝혔다.
지난 4월 제3차 IDMC에 이어 네 번째로 개최된 이번 회의에서 9월 2일을 기준으로 집계된 시험대상자 전체의 유효성 및 안전성 데이터를 검토한 결과, 전문가들은 이전 회의 결과와 동일하게 약물의 안전성 및 효과와 관련한 우려 없이 임상시험을 계획대로 이어나가도록 권고했다.
이번 임상시험에 참여하는 시험대상자 129명 중 82명이 24주 투약 절차를 모두 마무리한 가운데, 브릿지바이오는 이번 회의 결과에 따라 임상 마무리 절차를 더욱 가속화해 내년 4월 톱라인 데이터 발표 준비와 동시에 글로벌 기술이전 계약 협상을 통한 사업화에 더욱 매진할 계획이다.
이정규 브릿지바이오 대표는 “총 네 차례의 전문가 회의를 거쳐 약물의 안전성 및 효능을 확인받으며 혁신 신약 개발에 매진할 수 있게 돼 뜻깊게 생각한다”며 “글로벌 임상 연구자 및 환자, 유관 기관들의 적극적인 협력을 토대로 남은 시험 절차를 순조롭게 마무리하고, 경쟁력있는 데이터 발표를 통해 조속한 사업화 성과로 보답할 것”이라고 밝혔다.
라이프시맨틱스, ‘전립선암 위험평가 AI 소프트웨어’ 임상시험계획 승인
인공지능(AI) 기반 헬스케어 기업 라이프시맨틱스는 암 위험평가 소프트웨어(SW) 관련 임상시험 계획을 승인 받았다고 10일 밝혔다.
라이프시맨틱스는 이번 승인에 따라 전립선암 발생 위험도를 표시해주는 소프트웨어 의료기기의 임상적 효율성 검증을 위한 다기관, 단일군, 후향적, 우월성 검증, 확증 임상시험에 돌입할 예정이다.
라이프시맨틱스는 정부 주도 국가 연구사업인 과학기술정보통신부 주관 ‘닥터앤서 1.0’와 ‘닥터앤서 2.0’를 통해 기술력을 인정받았으며 ‘전립선암 병기·재발 예측 소프트웨어(S/W) 구축 및 관련 특허’ 2종을 취득한 바 있다.
라이프시맨틱스는 축적된 기술력을 바탕으로 피부암 영상 검출·진단보조, 전립선암 위험 평가, 혈압 분석 및 고혈압 합병증 예측, 모발 개수 분석 등의 기술을 개발해왔다.
라이프시맨틱스 관계자는 “이번 허가 및 임상을 통해 의료 AI 솔루션 시장에서의 입지를 더욱 확고히 다질 것으로 기대한다”고 말했다.
신풍제약, 골관절염 주사제 임상 3상 계획 변경 승인
신풍제약은 식품의약품안전처가 골관절염 주사요법제 ‘SP5M002주’의 임상 3상 시험변경계획을 승인했다고 11일 공시했다.
앞서 신풍제약은 2022년 11월 SP5M002주 임상 3상 시험계획을 신청하고 지난해 4월 승인받았으나 지난 8월 변경계획을 신청했다. 이후 2개월 만에 변경계획을 승인받았다. 신풍제약은 2026년 5월 해당 임상이 종료될 것으로 예상했다.
신풍제약 관계자는 “임상 3상에서 유효성과 안전성을 확인하는 경우 환자 편의성을 증대시키는 새로운 슬골관절염 치료제 옵션이 될 것으로 기대된다”고 말했다.
이 기사의 카테고리는 언론사의 분류를 따릅니다.
기사가 속한 카테고리는 언론사가 분류합니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.


