이 기사는 2024년03월07일 10시30분에 팜이데일리 프리미엄 콘텐츠로 선공개 되었습니다.
[이데일리 신민준 기자] 바이오벤처 1세대 지엔티파마가 신약 넬로넴다즈를 앞세워 실적 턴어라운드(개선)를 꾀한다. 넬로넴다즈는 세계 최초 심정지 및 다중 표적 뇌졸중 치료제로 평가받는다. 지엔티파마가 심정지 적응증과 관련해 국내 조건부 품목허가 신청을 앞두고 있는 만큼 이르면 내년쯤 상용화 가능성이 점쳐진다. 지엔티파마는 연내 코스닥시장 상장도 추진해 본격적으로 성장에 박차를 가한다는 전략이다.
 |
(그래픽=이데일리 김일환 기자) |
심정지 적응증 넬로넴다즈 이르면 내년 상용화 전망
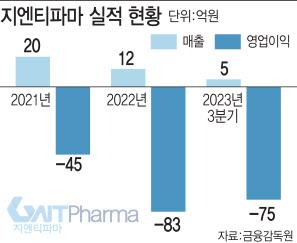
6일 제약·바이오업계에 따르면 지엔티파마는 지난해 3분기 매출 5억원, 영업손실 75억원을 기록했다. 지엔티파마는 1998년 곽병주 연세대 생명과학부 겸임교수가 아주대 교수 시절 창업한 벤처기업이다. 지엔티파마는 지난 26년간 뇌졸중 및 알츠하이머 치매를 치료할 수 있는 뇌세포 보호 신약 개발에 매진하고 있다.
지엔티파마는 넬로넴다즈를 포함한 3개의 신약을 개발하고 있다. 가장 큰 기대주는 바로 신약 1호인 넬로넴다즈다. 넬로넴다즈는 뇌졸중이나 심정지 후 발생하는 뇌세포 손상의 주원인인 글루타메이트 신경독성과 활성산소 독성을 동시에 제어하는 세계 최초의 심정지 치료제이자 다중표적 뇌신경세포 보호 약물이다.
지엔티파마는 심정지와 뇌졸중 적응증을 대상으로 각각의 임상을 진행하고 있다. 심정지 적응증은 미국과 중국에서 환자 165명을 대상으로 진행한 임상 1상에 이어 삼성서울병원과 전남대병원 등 국내 5개 대학병원에서 임상 2상을 끝내고, 식품의약품안전처에 조건부 품목허가 신청을 준비하고 있다. 국내 임상 2상은 심폐소생 후 혼수(코마) 상태의 심정지 환자 105명을 대상으로 6년간 진행했다.
국내 임상 2상 결과 약물 투여 90일 후 장애 없이 독립적으로 활동할 수 있는 환자의 비율이 현저히 높아졌다는 것이 지엔티파마 측의 설명이다. 아울러 환자에게 마지막 약물 투여 후 48시간 이내에 확산강조영상(MRI DWI)을 분석한 결과도 뇌의 신경전달통로인 백질에서 손상이 감소한 영역들을 확인했다. 투약과 관련한 부작용도 없었다고 지엔티파마 측은 밝혔다.
넬로넴다즈는 2019년 식품의약품안전처로부터 심정지 후 뇌 손상을 막는 개발 단계 희귀 의약품으로 지정됐다. 넬로넴다즈는 다음해인 2020년 희귀 질환 신약 개발 과제로 선정돼 보건복지부 등 정부의 지원을 받았다. 희귀 의약품으로 지정될 경우 임상 2상 이후 품목 조건부 허가를 받을 수 있어 신속한 상용화가 가능하다. 제약·바이오업계는 조건부 품목허가 신청에 따라 이르면 내년쯤 심정지 치료제의 상용화가 가능할 것으로 예상한다. 특히 심정지의 경우 환자의 생존율이 극히 낮은데다 세계적으로 치료제도 없는 만큼 넬로넴다즈가 출시될 경우 큰 반향을 일으킬 것으로 제약·바이오업계는 보고 있다.
세계 시장조사기관 데이터엠 인텔리전스에 따르면 전세계 심정지 치료제 시장 규모는 2021년 162억3000만 달러(약 22조원)에서 2030년 246억9000만달러(약 33조원)에 달할 전망이다. 연평균 성장률은 9.2%에 이른다. 제약·바이오업계는 넬로넴다즈가 세계 최초 심정지 치료제이자 다중표적 뇌졸중 치료제인 만큼 장기적으로 연간 1조원 이상의 매출을 올리는 블록버스터 신약이 될 수 있을 것으로 기대한다.
지엔티파마는 뇌졸중 적응증 대상으로 국내 24개 대학병원에서 1차 임상 3상도 마무리했다. 지엔티파마가 지난달 미국 애리조나 피닉스 컨벤션 센터에서 개최된 국제뇌졸중콘퍼런스(ISC2024)에서 공개한 넬로넴다즈의 임상 3상 결과에 따르면 뇌졸중 발병 후 응급실 도착 1시간 이내 환자에게 투여할 경우 장애 개선 효과가 위약(가짜약) 대비 5배 가까이 높은 것으로 나타났다.
임상 3상은 12시간 내 동맥 내 혈전제거술을 받은 환자 496명을 대상으로 진행됐다. 12주 후 치료제의 장애 개선 효과와 안전성을 분석한 결과, 응급실에 도착하고 1시간 내 넬로넴다즈를 투약한 환자군이 위약 투여군보다 장애 개선 치료 효과가 4.93배 높았다. 지엔티파마 측은 응급실에 도착하고 70분 안에 넬로넴다즈를 투여한 환자 40명의 경우에도 위약을 투여한 39명보다 장애 개선 효과가 유의미하게 높았다고 밝혔다. 뇌졸중 환자의 장애를 평가하는 수정랭킨척도(mRS) 분포와 비율도 넬로넴다즈와 위약 투여군에서 차이가 없게 나타나 넬로넴다즈의 안전성도 확인됐다고 지엔티파마 측은 설명했다.
지엔티파마는 뇌졸증 적응증의 경우 중국 39개 대학병원에서 1차 임상 3상을 진행하고 있다. 아울러 지엔티파마는 뇌졸중 적응증의 다국적 2차 임상 3상도 진행할 예정이다. 다국적 2차 임상 3상은 세계시장 진출을 목표로 응급실 도착 후 신속한 혈전제거술 시행과 넬로넴다즈 투여로 환자의 장애가 개선되는지를 확증하기 위한 취지로 풀이된다.
 |
넬로넴다즈. (사진=지엔티파마) |
유상증자와 더불어 주식 상장도 추진해 자금 확충
지엔티파마는 임상 비용을 마련하기 위해 자금도 확충한다. 지엔티파마는 최근 580억원 규모의 제3자배정 유상증자를 결정했다. 지엔티파마는 연내 코스닥시장도 추진한다. 지엔티파마는 2022년 9월 주식 상장을 위한 지정감사인도 신청했다. 지엔티파마의 장외 시가총액 규모(추정치)는 약 4700억원이다. 지엔티파마는 코스닥시장에 상장하게 되면 추가적인 자금도 확보할 수 있다.
지엔티파마는 반려견 인지기능장애증후군(치매) 치료제 제다큐어를 출시해 캐시카우(현금창출원)도 마련했다. 제다큐어는 사람의 알츠하이머 치매와 유사한 인지기능장애증후군을 앓고 있는 반려견에서 약효와 안전성이 입증돼 2021년 2월 국내 최초 합성신약 동물용의약품으로 승인을 받았다. 제다큐어는 현재 유한양행을 통해 1800개가 넘는 동물병원에서 처방되고 있다.
제다큐어의 국내 판매 소식이 알려지면서 미국을 비롯한 21개국에서 수백건의 구매 요청이 들어온 것으로 알려졌다. 지엔티파마는 제다큐어의 해외 시장 진출을 위해 세계적인 제약·바이오기업 화이자의 자회사 화이자 센터원과 선진의약품 제조·품질관리 기준(cGMP)에 따라 완제의약품을 생산하는 포괄적 협력계약을 체결했다.
지엔티파마 관계자는 “넬로넴다즈의 수년간의 임상시험에서 안전성과 약효가 확인된 만큼 신속하게 심정지 환자를 위한 희귀의약품으로 조건부 품목 허가를 신청할 것”이라며 “뇌졸중 치료제의 경우 글로벌 시장 진출을 위한 다국적 2차 임상 3상도 진행할 예정”이라고 말했다.
이 기사의 카테고리는 언론사의 분류를 따릅니다.
기사가 속한 카테고리는 언론사가 분류합니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.


