이 같은 결과는 앞서 위암 3차 치료 물질 '리보세라닙'의 1차 평가지표를 입증하지 못했지만, 2차 평가 지표에선 유의미한 결과가 도출돼 미국 식품의약국(FDA)에 신약허가 신청을 하겠다는 에이치엘비와 '평행이론'을 보여 관심을 받고 있다.
|
두 회사는 통계학적 유의성에 발목이 잡혀 1차 지표 입증에 실패했다. 대신 2차 지표의 중요성을 강조하며 FDA에 신약허가 신청에 나선다.
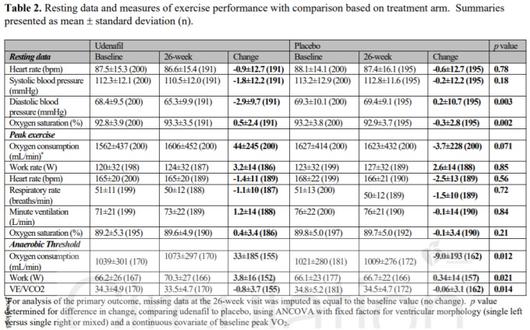
메지온의 유데나필은 단심실증 치료제 후보물질이다. 단심실증은 선천적으로 심장을 이루는 좌심실과 우심실 중 심실이 한 개만 있는 희귀질환인데, 환자들은 우심방-폐동맥 우회수술(폰탄수술)을 받아 증상을 완화할 수 있다. 하지만, 수술을 받았어도 시간이 지나면 심혈관계 기능과 운동능력이 떨어진다. 유데나필은 폰탄수술을 받은 청소년 환자의 운동기능을 개선하는 후보물질이다.
메지온은 17일(현지시간) 미국 필라델피아에서 열린 미국심장학회 학술대회(AHA 2019)에서 폰탄수술을 받은 청소년 환자 400명을 대상으로 진행한 유데나필의 임상 3상 결과, 1차 지표(VO2 max)를 입증하지 못했다고 발표했다.
임상 3상 1차 지표는 유데나필 26주 복용 환자의 최대 능력치에서 최대 산소소비량을 측정하는 'VO2 max'였다. 유데나필 복용군은 VO2 max값이 3.2% 향상돼 0%인 위약(가짜약) 복용군 보다 운동능력이 개선됐다. 하지만 통계학적 유의성을 달성하지 못했다. (p=0.07)
반면, 2차 지표에서는 유의미한 결과가 도출됐다. 유산소에서 무산소로 바뀌는 시점에서 산소소비량을 나타내는 2차 지표 'VO2 at VAT'는 유데나필 복용군이 2.9% 향상됐고, 위약군이 1% 감소했으며 통계적으로 유의한 차이가 나타났다. (p=0.009)
|
임상 3상 결과 발표를 맡은 데이비드 골드버그 필라델피아 소아병원 교수는 "VO2 at VAT가 중심정맥압에 제한을 받지 않기 때문에 환자의 운동능력을 측정하는 방법으로 훨씬 더 적합하다"고 설명했다. 메지온은 "임상의 긍정적 결과 및 다른 임상으로부터 취합된 안전성 데이터 등 자료를 기반으로 신속하게 NDA를 신청할 것"이라고 했다.
앞서 에이치엘비도 지난 9월 위암 2차 이상 표준 치료에 실패한 12개국 환자 460명을 대상으로 진행한 위암 3차 치료 신약 물질 '리보세라닙'의 글로벌 임상 3상 결과 1차 지표 입증에 실패했다.
리보세라닙 투약 환자의 전체 생존기간(OS)은 5.78개월이었고, 위약 투여군은 5.13개월이었다. 전체생존기간이란 치료 시작 후부터 사망에 이르는 기간으로 리보세라닙 OS의 절대값은 기존 위암 3차 치료제인 론서프(5.7개월), 옵디보(5.26개월)보다 길게 나타났다.
하지만 시험군과 위약군의 OS 격차가 0.65개월로 경쟁약인 론서프 2.1개월, 옵디보 1.2개월에 비해 현저히 낮아 유의성을 입증하지 못했다.
에이치엘비는 위약군 중 70여명이 암이 커지면서 임상시험을 마치고 위약 대신 다른 치료제를 투여했기 때문에 시험군과 위약군 간 OS 격차가 작은 것으로 풀이했다. 위약군의 생존기간이 길어지면서 통계적으로 유의한 결과를 내지 못했다는 것이다.
대신 1차 지표 OS 외에 2차 지표인 무진행 생존기간(PFS)을 강조했다. PFS는 암이 커지지 않고 환자가 생존하는 기간이다. 리보세라닙의 PFS는 2.83개월로, 론서프(2개월), 옵디보(1.6개월)보다 길었다.
|
◆ "2차 지표만으로 신약허가 자신 어려워"
2차 지표를 자신하며 신약허가 신청을 진행중인 두 회사 중에는 메지온이 앞서 있는 상황이다.
에이치엘비는 지난달 24일(현지시간) FDA와 신약허가 사전미팅을 진행했다. 30일 내 FDA로부터 회의록과 신약허가 관련 의견을 전달받는다.
메지온은 앞서 지난 10월 FDA의 심혈관 및 신장계열 부서(DCaRP)와 신약허가 신청 관련 미팅을 마치고 신약허가 신청서를 제출하라는 결론을 받았다.
두 회사가 1차 지표 대신 2차 지표에 자신감을 보이며 신약허가를 서두르고 있지만, 1차 지표를 입증하지 못한 만큼 신약허가 승인을 받지 못할 가능성도 배제할 수는 없다.
업계 한 관계자는 "1차 지표를 입증하지 못한 것은 임상시험을 설계할 때 내밀었던 것 중 첫번째 과제를 해결하지 못한 것이기 때문에 2차 지표가 좋다고 자신할 수는 없는 상황"이라고 말했다.
그는 이어 "임상 데이터나 시장 필요성 등 여러 요인을 분석한 후 FDA가 내리는 최종 결정을 지켜봐야 한다"고 했다.
allzero@newspim.com
이 기사의 카테고리는 언론사의 분류를 따릅니다.
기사가 속한 카테고리는 언론사가 분류합니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.