식약처, '국내 1위 인조혈관 스텐트 업체' 에스앤지바이오텍 고발조치
"추가 수사 후 제조업무 정지 검토"…이달 초엔 판매중지 및 제품회수
연합뉴스 탐사보도팀은 이 회사가 비허가 혈관용 스텐트를 제조·유통한 사실과 함께 식약처로부터 판매중지 조치를 당한 사실을 이달 13일 단독보도(https://www.yna.co.kr/view/AKR20190513069400501)한 바 있다.
식약처는 23일 에스앤지바이오텍이 2014년 이후 4천300개의 혈관용 스텐트를 허가 없이 생산해 대학병원 등 136개 의료기관에 납품해온 사실을 확인했다고 밝혔다.
식약처는 구체적인 병원 명단을 밝히지는 않았으나, 연합뉴스가 별도로 확인한 결과 서울을 포함한 전국 곳곳의 유명 병원이 여럿 포함돼 있었다.
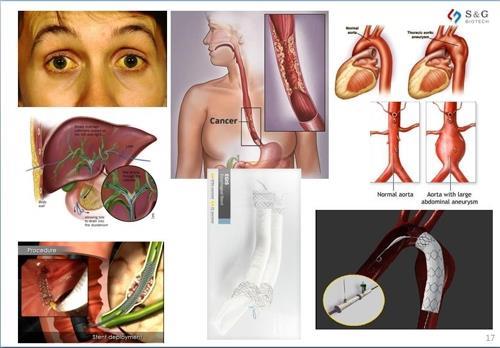 |
에스앤지바이오텍 스텐트 홍보자료 |
혈관용 스텐트는 혈관 벽이 찢어지는 '대동맥 박리증'이나 혈관벽이 부풀어 오르는 '대동맥류' 같은 고위험성 혈관 질환에 주로 사용되는 의료기기다. 혈관에 직접 삽입되는 기기인만큼, 정부는 혈관용 스텐트를 의료기기 위해도 등급(1∼4등급) 중 가장 위험성이 큰 4등급으로 분류해 관리하고 있다.
식약처에 따르면 적발된 에스앤지바이오텍의 제품들은 길이, 직경, 모양 등이 모두 허가사항과 달랐다.
또 스텐트를 체내에 삽입하는 방식과 원자재 등도 허가사항과 다르게 제조한 것으로 드러났다.
에스앤지바이오텍은 이런 비허가 제조 및 납품 사실을 숨기기 위해 병원 등에 납품하는 제품 포장 박스에는 허가받은 모델명을 거짓으로 기재하고, 실제로는 비허가 제품을 넣어 판매한 것으로 확인됐다.
이와 함께 납품을 받은 의료기관이 허가 번호와 실제 제품을 혼동하지 않도록 실제로 공급된 비허가 제품의 도면을 포장 박스에 함께 표시함으로써 구분해 사용할 수 있도록 하는 수법을 썼다는 것이 식약처의 설명이다.
식약처는 이에 따라 식약처 내부 위해사범중앙조사단에 해당 업체를 고발조치해 정식으로 수사를 개시했다.
이에 앞서 식약처는 지난 9일 에스앤지바이오텍의 비허가 혈관용 스텐트 제품들에 대해 판매중지와 회수 명령을 내리는 등 행정조치를 한 바 있다. 동시에 이미 제품을 공급받은 136개 의료기관에 해당 제품의 사용을 중지하도록 협조 요청도 했다.
식약처 관계자는 "업체 점검 때 확인되지 않은 2013년도 이전의 제품 유통기록과 추가적인 위법사실 등에 대해 수사 중이며, 결과에 따라 제조 업무정지 등 행정처분을 할 계획"이라고 밝혔다.
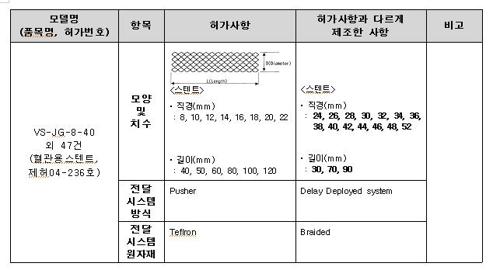 |
에스앤지바이오텍 비허가 스텐트 판매 적발 |
식약처는 비허가 제품을 시술받은 환자들의 안정성과 관련해 대한흉부외과학회와 대한영상의학회 등을 통해 임상전문의와 의공학 교수 등의 자문을 구했다며 "허가받은 스텐트와 원재료가 같아 의학적 위험성이 크지 않아 재시술 등의 필요성은 낮으며, 담당 의사의 판단에 따른 정기검사를 통해 환자 상태를 확인하면 충분하다는 의견이었다"고 전했다.
식약처는 현재 시술환자의 정확한 현황을 파악 중이며 의료기관이 환자에게 개별 통보하도록 조치할 계획이라고 덧붙였다.
식약처는 이번 수사와 함께 공인된 검사기관을 통해 회수 제품을 대상으로 스텐트의 성능과 관련된 탄성력회복, 압축하중, 부식 등에 관한 시험을 진행 중이라고 밝혔다. 또 앞으로 유사한 사례가 발생하지 않도록 고위험 의료기기에 대한 점검을 강화할 계획이라고 설명했다.
식약처 조사 결과와 관련해 강성권 에스앤지바이오텍 대표는 "4천300개 중에서 대부분은 허가제품의 사양이 변경된 것이다. 허가받은 사항에 새로 규격만 추가한 제품이므로 모두 비허가 제품으로는 볼 수 없다"라고 주장했다.
그는 "(비허가 또는 비인증 제품에 대한) 방지대책을 세우고 있고 (적발된 제품들은) 가능하면 이른 시일 안에 사양 변경을 신청해서 허가사항으로 만들 계획"이라고 주장했다.
 |
비허가 스텐트의 2가지 모델명 |
ohyes@yna.co.kr
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>
이 기사의 카테고리는 언론사의 분류를 따릅니다.
기사가 속한 카테고리는 언론사가 분류합니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.
언론사는 한 기사를 두 개 이상의 카테고리로 분류할 수 있습니다.


